作者:和渊 等(中国人民大学附属中学)
2023 年的诺贝尔生理学或医学奖颁发给了mRNA 疫苗研发团队卡塔琳·考里科(KatalinKarikó)和德鲁·魏斯曼(Drew Weissman),理由是“他们在核苷碱基修饰方面的发现,这些发现使得针对COVID-19(新型冠状病毒)感染的有效mRNA疫苗得以开发”。卡塔琳·考里科和德鲁·魏斯曼将体外合成的mRNA中的假尿苷替换为尿苷注射到机体后,不仅可以减少机体自身的免疫反应,而且还能极大增加mRNA的翻译效率。本文简单介绍mRNA疫苗的研发流程。
1 疫苗的作用和类型
疫苗是指用各类病原微生物制作的用于预防接种的生物制品,即把减活或者灭活的病原体(或者活性成分)注射到身体内,使自身产生对抗病原体的能力。常用的新型冠状病毒(以下简称新冠病毒)感染疫苗主要包括灭活疫苗、重组蛋白疫苗、腺病毒载体疫苗和mRNA疫苗等。
灭活疫苗、重组蛋白疫苗、腺病毒载体疫苗等是最常见的疫苗,其研发过程比较复杂,需要不断地培育、挑选、处理,在制作完成之后还要经过动物实验和人体临床试验,确认安全且有效之后才能批准入市,这一整个过程可能需要10 年之久,长周期的疫苗研发流程对于亟需防治的新冠病毒感染过于漫长。
mRNA疫苗的设计和生产比传统疫苗的研发周期要缩短很多。一旦已知了目标病原体的遗传信息,就可以相对迅速地开始生产疫苗,而无须像传统方式一样培养和处理活病毒或蛋白质抗原。且由于不需要使用活病毒,减少了疫苗生产过程中的生物感染风险。由此可见,mRNA疫苗是一种比较理想的疫苗类型。
2 mRNA疫苗的研制思路
利用mRNA研制疫苗的思路是:确定病原体关键蛋白(如新冠病毒刺突蛋白),以此为依据推测其编码基因的序列并体外合成关键蛋白的mRNA,把合成的mRNA注入人体,让mRNA指导人体细胞合成刺突蛋白,并引发人体的免疫应答。
2.1 确定病原体关键蛋白,并以此为依据推测其编码基因的序列 通过生物信息学比较不同物种或毒株的病原体,找出高度保守的蛋白质或序列;或者通过免疫筛查找出诱导强烈免疫应答的病原体蛋白质;通过共沉淀、酵母双杂交、亲和纯化等经典的生化实验操作,找出在感染过程中起关键作用的病原体蛋白。找出病原体侵染的关键蛋白(抗原决定簇)后,通过乙酸纤维电泳、质谱法、核磁共振法等对蛋白质进行鉴定,确定其氨基酸序列。然后,使用Basic Local Alignment Search Tool(BLAST)在 GenBank或其他相关的生物信息学数据库中对蛋白质序列进行搜索,找出与蛋白质序列高度相似的已知序列,从而推测这些序列对应的病毒基因序列。
2.2 体外合成mRNA 体外合成mRNA的技术,通常称为体外转录(in vitro transcription,IVT)。对于RNA病毒,先提取总RNA,逆转录形成DNA,再使用DNA模板生成mRNA,具体流程为:DNA模板准备—转录反应—在mRNA上加帽和加尾—RNA纯化。
1)DNA模板准备。DNA模板通常为线性化的质粒,含有所需的mRNA序列及一个能被RNA聚合酶识别的启动子,通过聚合酶链式反应(PCR)将DNA模板准备好,为下一步的转录反应奠定基础。
2)转录反应。将DNA模板、三磷酸核苷(NTPs)、RNA 聚合酶(如T7、T3或SP6 RNA聚合酶,取决于启动子的类型)、缓冲液及其他必要的因子等混合,利用RNA聚合酶进行体外转录,得到mRNA分子。
3)在mRNA上加帽和加尾。在转录完成后或与转录同时,在反应体系中添加加帽酶(cappingenzyme)和适当的供体分子(如GTP或甲基化的GTP),形成5′端的帽子结构;同时,使用多聚A聚合酶添加poly(A)尾,形成3′端的多聚腺苷酸尾,即可获得成熟的mRNA。
4)RNA纯化。转录后,由于新合成的mRNA含有未掺入的NTPs、DNA模板和其他杂质,需要通过一定手段去除,从而得到纯化的mRNA。
2.3 将外源合成的mRNA注入人体,激发人体免疫应答 外源合成的mRNA被注射到体内后,会通过体液运输,进入巨噬细胞等抗原呈递细胞(APCs)。之后,mRNA在抗原呈递细胞内部表达出相应的病原体蛋白,并呈递到细胞表面,激活辅助性T细胞,进而激活T细胞和B细胞,使得B细胞产生相关抗体,细胞毒性T细胞裂解被抗原侵染的细胞。mRNA疫苗的工作机制如图1所示。
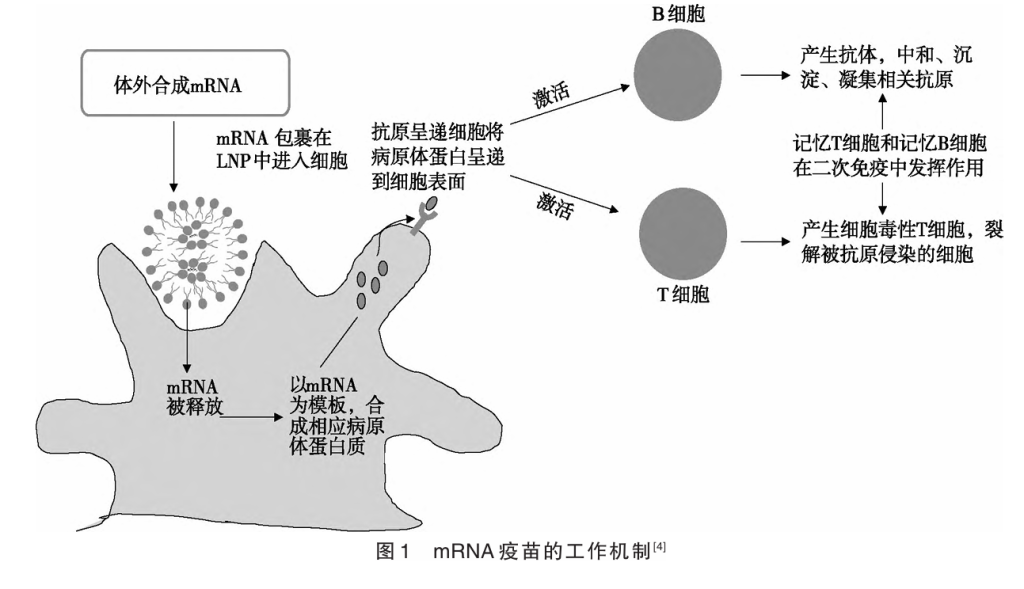
此过程中面临3个重要的科学问题:外源mRNA进入细胞中能否指导蛋白质的翻译?外源mRNA诱发人体先天免疫系统从而导致严重的细胞炎症反应怎么解决?mRNA在运输过程中容易被降解怎么解决?下文分别对这3个问题进行阐述。
2.3.1 外源mRNA进入细胞后能否作为模板指导翻译 经由细胞核转录形成的内源mRNA可以翻译形成蛋白质,外源mRNA进到人体细胞中后,能否指导细胞内形成蛋白质?1990年,威斯康星大学一个研究团队,将mRNA注射到小鼠体内,并检测到了相应的蛋白表达。1992年,另一个研究团队在大鼠中进一步证明,体外注入的mRNA表达出的蛋白质还具有生理活性。这意味着外源合成的mRNA进入细胞后仍旧可以指导细胞合成蛋白质(如刺突蛋白),因此,mRNA可以作为抗原激发人体产生免疫反应,从而起到疫苗的作用。
2.3.2 外源mRNA导致细胞炎症的解决方法 尽管外源mRNA可以指导细胞内蛋白质的形成,但是其本身作为一种外来物质,可以被机体识别,诱发细胞的先天免疫系统活化,从而使外源mRNA降解而无法翻译为抗原蛋白分子,也无法引起有效的免疫保护。如何防止mRNA被人体识别?
考里科和魏斯曼发现,外源RNA会被Tolllike receptor(TLR)识别。而之所以会被识别,是因为外源RNA与哺乳动物内源RNA不同,缺乏某些修饰,这种修饰的区别体现为:哺乳动物中的RNA中具有假尿苷,被称为第5种核苷酸,但体外合成的外源RNA没有假尿苷的修饰。因此,外源RNA由于缺乏假尿苷的修饰会被机体免疫系统识别,从而导致炎症反应。于是,考里科和魏斯曼把外源mRNA上的尿苷替换成了假尿苷,外源mRNA 不再产生严重炎症反应,因此,解决了mRNA在人体内应用的安全性问题。
考里科等还做了后续实验,去除了双链RNA对mRNA进行的纯化,不仅减少了细胞内炎症的发生,而且增加了翻译的效率,提高了mRNA的应用效率。
2.3.3 mRNA在运输过程中容易被降解的解决方法 mRNA非常容易被降解,尚未被运输到相关细胞内作为模板指导翻译形成抗原蛋白分子之前,就有可能被降解。该如何解决?研究人员构建出一个脂质纳米颗粒运载系统LNP(lipid nanoparticles)(图2),修饰后的mRNA由脂质纳米颗粒载体递送到人体细胞中,能避免mRNA被机体分解,并且能够刺激免疫系统产生抗体,中和入侵的病毒,该方法比完全依赖免疫系统本身效果更好。
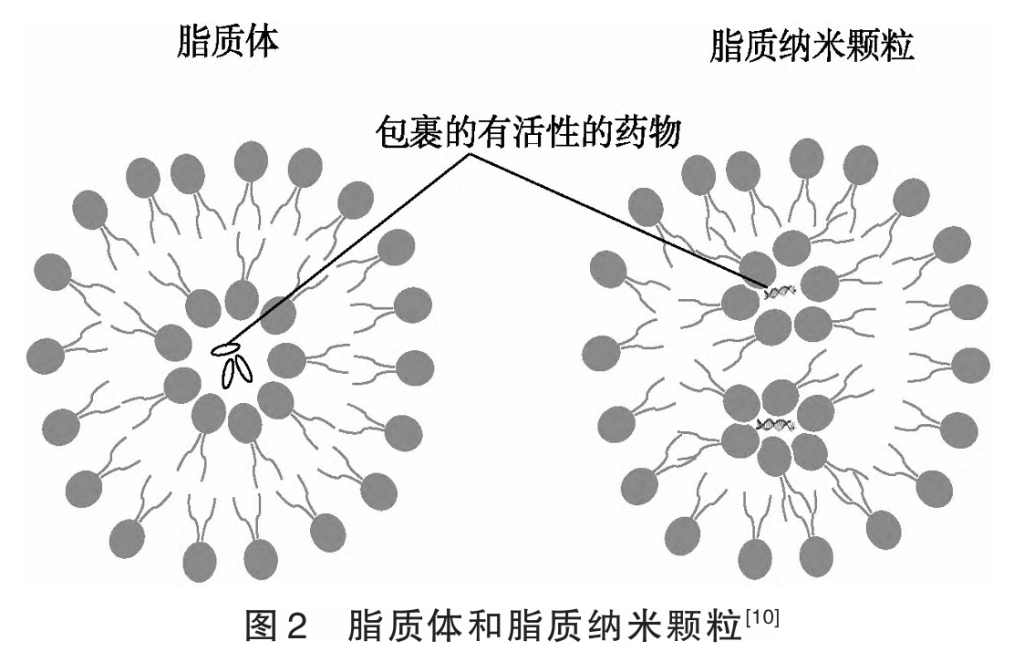
能沿着肿瘤附近的破碎血管进入细胞,帮助运输癌症药物,但结构简单的普通脂质体为中性或略带负电荷,这使得其很难有效地与带负电的酸性DNA或RNA结合。科学家设想,给脂质体添加带有正电荷的脂质,可以与带有负电荷的核酸形成稳定平衡。使用永久带有正电荷的人造脂质会带来巨大的毒性,因为这些脂质会破坏细胞膜结构。如何解决这个问题?科学家的策略是使用可电离的脂质,让其在特定的条件下(如酸性环境),短暂携带正电荷,这样就能与核酸结合,将RNA包裹在其中,进行投递。
综上所述,考里科和魏斯曼的工作解决了mRNA作为疫苗的稳定性差(稳定性)、体内效率低下(有效性)和激发机体先天免疫系统(安全性)的问题,使人工合成的mRNA能够安全地注射到人类细胞内,为疫苗研发作出了突出贡献。
mRNA新冠病毒疫苗的成功,让科研人员开始寻求包括流感、诺如病毒、疟疾、肺结核、登革热、寨卡病毒、艾滋病等各种疾病的mRNA疗法。同时,mRNA疗法的研究还扩大到了其他领域,例如,治疗一些癌症、食物和环境过敏以及自身免疫病,相信mRNA疫苗和mRNA疗法在未来具有广阔的应用前景。
文章来源:和渊,王一苇,鲁冰,等.关于mRNA疫苗研发的解读[J].生物学通报,2024,59(10):88-91.



 扫码安装网站APP(Android版)
扫码安装网站APP(Android版)



近期评论