来源公众号:生物药笔记 作者:麋鹿先生

本文内容部分来源于网络,仅进行翻译、编辑和整理,版权归原作者所有,本文仅作为知识分享和学习使用,不用做商业用途,如存在侵权请联系公众号删除。
一、前言
当电流施加到含有带电物质的介质上时,这些物质将向相反的电荷迁移。根据它们移动的介质,其他特征(例如存在的物种的大小)会影响它们的运动,从而导致分离。这是电泳技术(如琼脂糖凝胶电泳)的基础,这些技术在生命科学中得到广泛应用。
琼脂糖凝胶电泳是一种用于生物化学、分子生物学、遗传学和临床化学的凝胶电泳方法,用于分离琼脂糖基质中的混合大分子群,如 DNA、RNA 或蛋白质。
琼脂糖凝胶电泳是最常见的电泳技术之一,操作相对简单明了,但具有很强的分离能力。琼脂糖凝胶由微小的孔组成,这些孔充当分子筛,根据电荷、大小和形状分离分子。
本文将从琼脂糖凝胶电泳的原理、构造、步骤、用途等方面,带大家全面了解。同时提供演示视频以便大家了解和学习。
二、什么是琼脂糖凝胶电泳
琼脂糖凝胶电泳是一种电泳形式,用于根据核酸(DNA或RNA)片段的大小分离核酸片段。当施加电流时,带负电荷的DNA/RNA通过琼脂糖凝胶的孔向凝胶带正电荷的一端迁移,较小的片段迁移得更快。然后可以使用紫外线 (UV) 观察生成的条带。
然而,核糖核酸往往会形成二级结构,有时同片段有多个不同的结构,这会影响它的迁移方式。因此,观察到的波段并不总是代表其真实大小,并且图像模糊。因此,天然琼脂糖凝胶(条件不会破坏分析物的天然结构)往往不用于分析RNA大小。替代方法包括Northern印迹和变性琼脂糖凝胶电泳这些使用能够破坏次级结构的条件。
琼脂糖凝胶也可用于分离蛋白质,根据它们的大小和电荷(与DNA/RNA不同,蛋白质的电荷根据掺入的氨基酸而变化)。然而,由于琼脂糖凝胶的孔径较大,蛋白质通常在孔较小的聚丙烯酰胺凝胶上分离,从而为小分子蛋白质分子提供更高的分辨率。
因此,在本文重点介绍DNA琼脂糖凝胶电泳。
三、凝胶电泳的工作原理
琼脂糖是一种经过纯化的琼脂,是海洋红藻细胞壁的碳水化合物结构组成部分。琼脂糖是一种分子量约为120,000的无支链(线性)聚合物,含有800-1000个单糖。琼脂糖链由一种重复的异二糖-即-D-半乳糖和3,6-酐-α-L-半乳糖通过1-4糖苷键结合而成。双糖单位,也称琼脂二糖,通过a-1、3连接形成了一个链。

琼脂糖的结构单元
琼脂糖溶液加热并冷却后,就会形成凝胶基质。其孔洞直径从50到200纳米不等,由凝胶浓度控制。温度高于90℃,琼脂糖便会融化,变成无规卷曲。冷却后,两个琼脂糖链形成由氢键连接的螺旋纤维。进一步冷却至胶凝固点以下(通常小于40°C),则会有更多氢键连接形成螺旋束网络,进而形成具有三维网格的凝胶。由于氢键,琼脂糖形成的凝胶加热可逆。因此,通过溶解含有目的片段的凝胶,可提取电泳分离出的核酸。

琼脂糖凝胶中的孔形成和温度诱导的状态转变
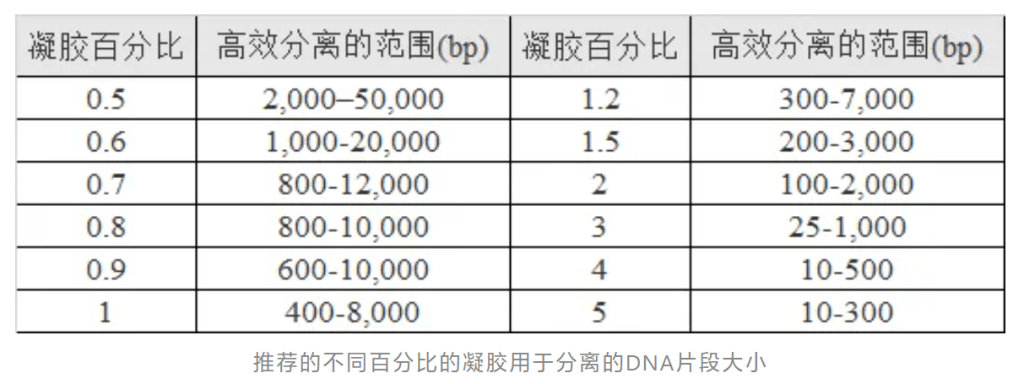
凝胶中包含的琼脂糖百分比会影响孔径,从而影响可能通过的分子的大小以及它们通过的速度。琼脂糖的百分比越高,孔径越小,因此能够通过的分子越小,迁移越慢。在分子生物学实验室中,0.7-1%琼脂糖凝胶通常用于日常DNA分离,可在0.2-10 kb范围内对片段进行良好、清晰的区分。使用较低百分比的凝胶可以分离较大的片段,但它们会变得非常脆弱且难以处理,而较高百分比的凝胶将提供更好的小片段分辨率,但较脆且可能凝固不均匀。
由于肉眼看不到DNA,因此在凝固过程中会在凝胶中掺入嵌入染料,例如溴化乙锭 (EtBr)。这会结合DNA并在紫外光下发出荧光,从而可以观察DNA片段。存在的 DNA越多,条带越亮。
将与上样染料混合的样品置于凝胶的一端,该凝胶浸入电泳缓冲液中。然后,电流通过凝胶槽两端的电极穿过凝胶。

琼脂糖凝胶电泳设置示意图。琼脂糖凝胶位于缓冲液罐中,将与负载染料混合的样品置于凝胶一端的孔中,并施加电流,使带负电荷的DNA向正极移动
当样品运行足够长以获得充分的分离时,将凝胶从槽中取出并放置在UV灯箱上。然后,嵌入染料可以观察样品条带,并与具有已知条带大小的DNA分子量Marker进行比较来确定它们的大小。迁移距离和片段大小之间的关系是非线性的。

四、琼脂糖凝胶电泳步骤
1. 凝胶的制备
- 称取适当质量的琼脂糖放入锥形瓶中。琼脂糖凝胶使用w/v百分比溶液制备。凝胶中琼脂糖的浓度取决于要分离的DNA片段的大小,大多数凝胶在0.5%-2%之间。缓冲液的体积不应大于培养瓶容量的1/3。
- 向含琼脂糖的培养瓶中加入电泳缓冲液。旋转混合。最常见的凝胶电泳缓冲液是TAE(40 mMTris-乙酸盐,1 mM EDTA)和TBE(45 mM Tris-硼酸盐,1 mM EDTA)。两者都有接近中性的pH值,有利于带负电荷的核酸。
- 熔化琼脂糖/缓冲液混合物。这通常是通过在微波炉中加热来完成的。每隔30秒,取出烧瓶并旋转内容物以充分混合。重复直到琼脂糖完全溶解。
- 加入溴化乙锭(EtBr)至浓度为0.5 μg/ml。或者,也可以在含有0.5 μg/ml EtBr的电泳缓冲液中电泳15-30分钟后对凝胶进行染色,然后在电泳缓冲液中脱色相同的时间。
注意:EtBr是一种致癌物,必须根据规定妥善处理。处理含有EtBr的凝胶时,应始终戴手套。可用于DNA染色的替代染料可用;然而,由于其敏感性和成本,EtBr仍然是最受欢迎的一种。
- 让琼脂糖在工作台上冷却或在65°C水浴中孵育。否则,凝胶托盘会翘曲。
- 将凝胶托盘放入灌注装置中。或者,也可以用胶带粘住凝胶托盘的开口边缘以制作模具。将合适的梳子放入凝胶模具中以创建孔。
- 将熔融的琼脂糖倒入凝胶模具中。让琼脂糖在室温下凝固。取下电泳梳,将凝胶放入凝胶盒中,确保孔位于负端(黑色电极)。或者,也可以将凝胶包裹在保鲜膜中并储存在4 °C直至使用。

2. 上样和DNA片段的分离
- 将上样染料(loading buffer)添加到要分离的DNA样品中。loading buffer通常以6X浓度(0.25%溴酚蓝、0.25%二甲苯蓝、30%甘油)制成。loading buffer有助于追踪DNA样品的移动距离,使样品-染料混合物更致密,它会沉淀在孔的底部。同时可以更容易准确地将样品移液到孔中,从而降低孔之间样品交叉污染的可能性。

- 尽量避免用移液器吸头接触孔的边缘,因为它们可能会破裂并让一个样品流入下一个样品。同时上样量不要超过孔的最大载量。
- 同时在运行凝胶时,添加含有已知大小的核酸参照样品(分子标准,Marker),用于目的样品大小的估计。但Marker上样量最好参照厂商推荐量,不宜过高,否则会造成条带污点并遮盖附近条带。
- 将电源编程为所需的电压(电极之间1-5V/cm)。通常可以120V持续35分钟左右,当然,这应根据使用的凝胶百分比和片段大小进行定制。
- 向琼脂糖凝胶施加电流会导致其加热,电压越高,热量就越高,因此当运行低百分比凝胶时,建议使用较低的电压以防止熔化。增加电压可以跑的更快,然而,这可能会导致“笑脸条带”,其中条带的每一端都向上弯曲,从而难以确定正确的条带尺寸。
- 添加足够的电泳缓冲液以覆盖凝胶表面。使用与制备凝胶相同的电泳缓冲液非常重要。
- 将电极从黑色到黑色、红色到红色的电极盖在电槽上,然后将电极插入电源组,也从黑色到黑色和红色到红色。
- 将凝胶盒的导线连接到电源。打开电源并验证凝胶盒和电源是否正常工作。
- 盖上凝胶盒的盖子。阴极(黑色引线)应比阳极(红色引线)更靠近孔。仔细检查电极是否插入电源中的正确插槽。
- 打开电源。运行凝胶,直到染料迁移到适当的距离。

3. 观察分离的DNA片段
- 电泳完成后,关闭电源并取下凝胶盒盖。
- 从凝胶盒中取出凝胶。从凝胶表面排出多余的缓冲液。将凝胶托盘放在纸巾上以吸收任何额外的电泳缓冲液。
- 从凝胶托盘中取出凝胶,将凝胶暴露在紫外线下。这通常使用凝胶成像系统完成。DNA条带应显示为橙色荧光条带。

4.演示视频
视频来自于文献1,版权归原作者所有,下载、转载等行为请注明原作者。
五、用途
1.样品DNA的可视化:
确定样品中是否存在DNA–例如,可以确认DNA提取或PCR是否有效,因此在诊断测试的情况下可以确定样品是阳性还是阴性。
确定存在的DNA片段的大小–例如,如果进行PCR或限制性酶切,条带是否为预期大小?这可以确认基因工程实验是否成功,或者可能表明是否存在基因插入、缺失或重复区域,这可以用作某些遗传病的诊断工具。在为二代测序制备DNA时,用于文库制备的片段化DNA必须具有正确的大小,以便进行高效测序。
存在的DNA量–尽管有更准确的精确方法DNA定量,例如紫外-可见光谱法,当在凝胶上运行样品时,产生的条带强度可以粗略地了解样品中DNA相对于其他样品的量。
样品的清洁程度–虽然在某些情况下可能会出现拖尾条带,例如在运行整个基因组DNA 时,但PCR或限制性酶切通常可能会产生清晰、清晰的条带。弥漫条带或弥散条带可能表明PCR条件或引物不理想、消化不完全或存在干扰污染物,例如DNA样品中的 RNA。
2.分离DNA片段进行纯化下游应用(如克隆)需要DNA片段的地方,或在限制性酶切后,可能需要从总样品中的其他DNA片段中分离出特定大小的DNA片段。为此,可以在凝胶上用完消化或扩增的样品,并切除含有目标片段的凝胶片。
3.分离用于Southern印迹Southern印迹是一种用于检测样品中特定DNA序列的技术。然而,为了做到这一点,首先必须通过琼脂糖凝胶电泳分离DNA片段,然后才能探测目标序列。
4.电泳迁移率变化测定(EMSA)
EMSA,也称为凝胶迁移检测,用于检测蛋白质和核酸之间的相互作用。示例可能包括转录因子的结合、促进或阻止基因表达。当蛋白质与DNA片段结合时,它会改变它通过琼脂糖凝胶迁移的方式,从而产生“偏移”。因此,通过运行有和没有推定的DNA结合蛋白的DNA片段的不同组合,可以确定何时发生结合或未发生,从而确定靶序列。



 扫码安装网站APP(Android版)
扫码安装网站APP(Android版)



近期评论