来源公众号:bioinfotec 作者:bioinfotec
原核生物(比如细菌)面对病毒的攻击,进化出了类似“免疫系统”的保护机制,其中最有名的就是 CRISPR-Cas系统。
它的原理就像“记仇本”+“智能导弹”:当病毒第一次入侵时,细菌会把病毒的一小段DNA保存下来,放进自己的“记仇本”——CRISPR 序列中。下次这个病毒再来,细菌就会根据这段“记仇信息”制造一小段引导RNA(crRNA),再配合 Cas 蛋白,就能像发射精准导弹一样,把病毒的DNA找到并切断,从而干掉病毒。
科学家把这种系统简化后应用到实验中,尤其是 CRISPR-Cas9 工具,现在已经成为非常强大的基因编辑手段。它可以用来“剪切”并修改各种细胞或生物的DNA,广泛用于科研和未来的疾病治疗。
发现历史
早在1987年,日本科学家Ishino及其团队在研究大肠杆菌碱性磷酸酶基因时,意外发现了这些不寻常的重复序列与spacer(间隔序列),这标志着 CRISPR 的最初发现。但他们当时并不知道这些序列的生物学功能。
到了1990年,Francisco Mojica 在其他原核生物中也发现了类似序列,并首次将其命名为“CRISPR”。然而这些序列的具体功能仍不清楚。
直到2007年,科学家们才通过实验确定 CRISPR 是原核生物抗病毒的关键免疫机制。
在深入研究了 CRISPR 机制之后,科学家意识到:这一系统不仅能在原核生物中防御病毒,也可以被应用于植物、人类及其他微生物的基因编辑。
2012年,Jennifer Doudna 和 Emmanuelle Charpentier 发现,只需提供合适的模板,CRISPR/Cas9 就能像“分子剪刀”一样精准编辑任意DNA。
从那时起,CRISPR/Cas9 成为了迄今为止最有效、高效且精确的基因编辑技术,并在多个应用领域被广泛采用。
CRISPR-Cas系统分类
根据 Cas 蛋白的结构和功能,CRISPR/Cas 系统可分为 I 类(包括 I 型、III 型和 IV 型) 和 II 类(包括 II 型、V 型和 VI 型)。I 类系统由多个 Cas 蛋白亚基构成的复合物组成,而 II 类系统仅使用一个 Cas 蛋白。
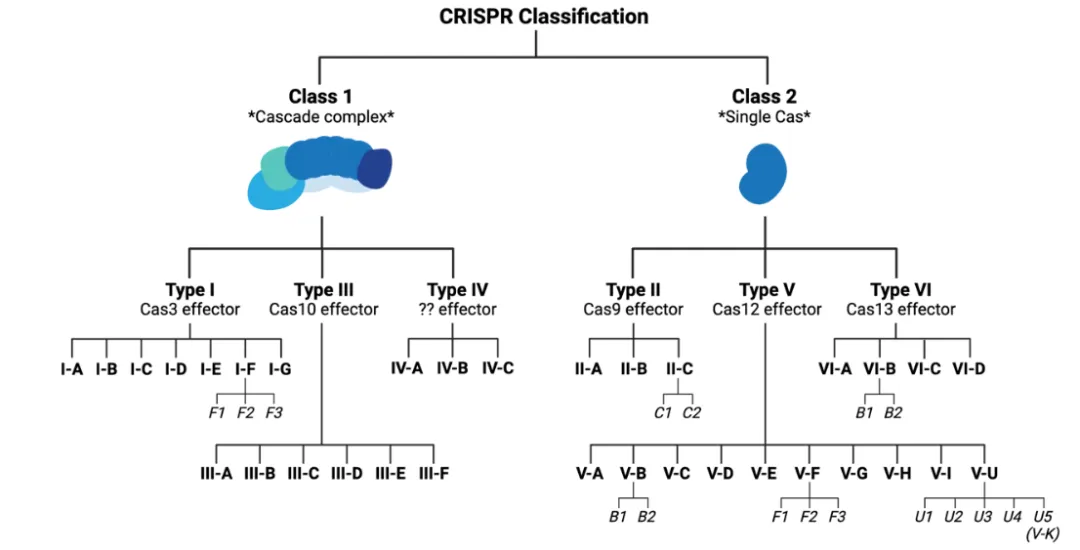
由于 II 型 CRISPR/Cas-9 系统结构相对简单,因此研究较为深入。
CRISPR-Cas9系统组成
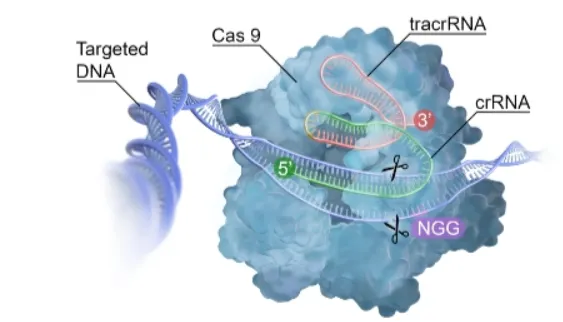
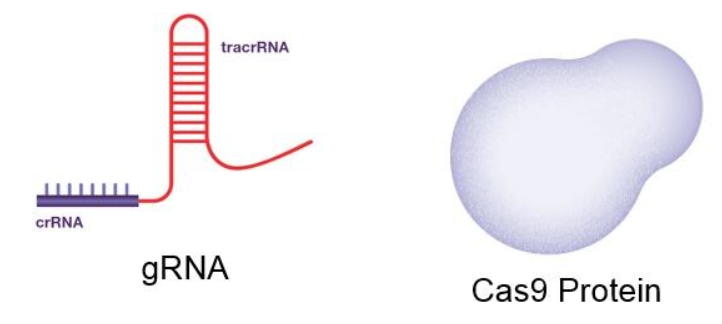
引导 RNA(gRNA)和 CRISPR 相关蛋白(Cas9)是 CRISPR/Cas9 系统中的两个关键组成部分。
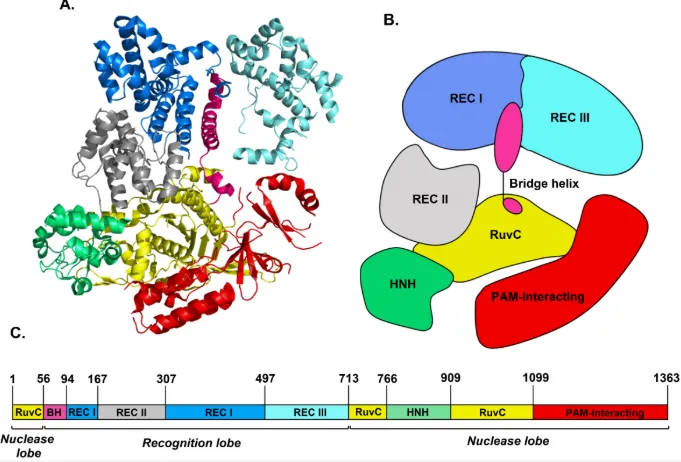
Cas-9 蛋白是首个被应用于基因编辑的 Cas 蛋白,来源于化脓性链球菌(Streptococcus pyogenes,即 SpCas-9)。该蛋白是一种大型(1368 个氨基酸)多结构域 DNA 内切酶,负责切割目标 DNA,形成双链断裂,因此也被称为“基因剪刀”。
Cas9 蛋白的结构可以分为两个主要功能区:一个是识别区,用来结合引导 RNA;另一个是切割区,真正执行 DNA 剪切。识别区包含 REC1 和 REC2 两部分;而切割区则包括两个负责剪断 DNA 单链的区域(RuvC 和 HNH),以及一个识别 PAM 序列的区域,这个 PAM 序列的识别是 Cas9 能否正确找到目标 DNA 的前提。
天然的引导 RNA 包含两部分:一段短小的 crRNA,负责精准识别目标 DNA;另一段是 tracrRNA,结构更复杂,提供 Cas9 蛋白结合的平台。尽管在自然界中这两部分是独立的,但在实验中,为了简化操作,科研人员将二者合成为一体,称为单一引导 RNA(sgRNA),这样就能灵活靶向和编辑任意基因序列。为了能够切割 DNA,在引导 RNA 的 3′ 末端,必须存在一个由 2 到 5 个核苷酸组成的特定 DNA 序列(该序列的具体内容取决于产生该 Cas9 的细菌种类),这个序列被称为PAM(原间隔序列邻接基序)。
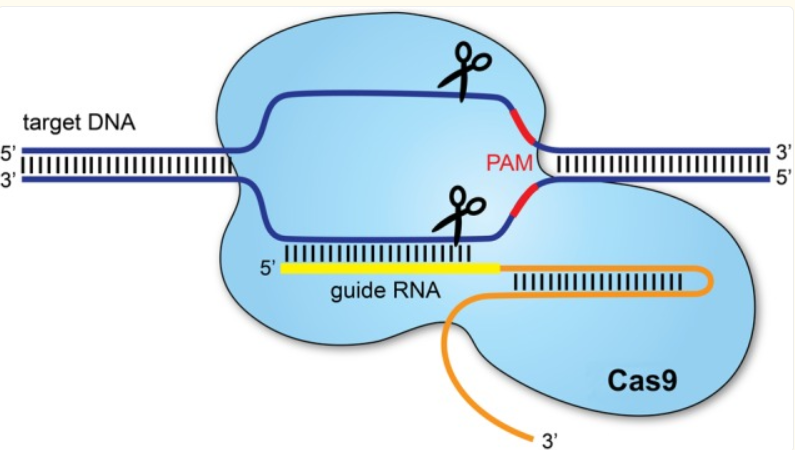
CRISPR-Cas9工作机制
CRISPR-Cas9系统的工作机制主要可以分为三个阶段:适应(adaptation)、表达(expression)和干扰(interference)。
在适应阶段,细菌通过 Cas9蛋白识别入侵的噬菌体(病毒)基因组中的特定短序列,这些序列被称为“原间隔序列”(protospacers)。Cas9蛋白切割这些序列,并将它们插入到细菌自身基因组中的 CRISPR 阵列里,这个过程依赖于靠近 protospacer 的一个保守短序列,叫做“原间隔序列邻近基序”(PAM)。PAM 的存在对于识别和切割是必不可少的。
进入表达阶段后,插入的间隔序列和相邻的重复序列会被转录成一种叫做前体 CRISPR RNA(pre-crRNA)的长 RNA 分子。pre-crRNA 经过加工切割,生成成熟的 crRNA,这些 crRNA 包含了识别外来 DNA 的序列信息。在CRISPR-Cas9系统中,还有另一种 RNA 分子叫做转激活 crRNA(tracrRNA),它能与 pre-crRNA 结合,形成双 RNA 结构,起到稳定和引导 Cas 蛋白的作用。
在干扰阶段,成熟的 crRNA 和 Cas 蛋白复合形成一个复合体,这个复合体会在入侵的病毒基因组中寻找与 crRNA 匹配的序列。一旦匹配成功,Cas9 蛋白中的核酸酶会切割病毒 DNA,最终破坏病毒基因组,实现免疫防御。
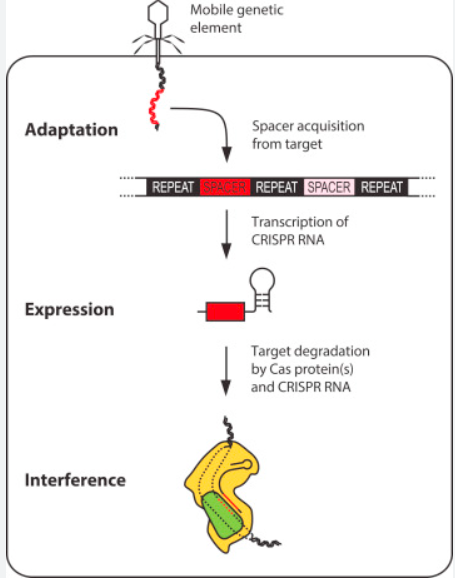
CRISPR-Cas 基因编辑
科学家们将这种天然免疫系统改造为基因编辑工具。通过人工设计 crRNA 的序列,可以让 CRISPR-Cas 系统靶向并剪切任何感兴趣的基因区域,从而成为一把高效精准的“分子剪刀”。
基因编辑的核心步骤是先由 Cas 蛋白在目标 DNA 位置制造双链断裂(DSB),然后由细胞内的 DNA 修复机制修复这些断裂。细胞修复 DSB 主要有两条路径:
同源定向修复(HDR)
细胞利用一段带有与断裂两端相同或相似序列的 DNA 作为模板,通过同源重组修复断裂。如果在基因编辑实验中提供了一个带有所需序列变化的“供体模板”,细胞就会将该模板序列插入断裂部位,实现精准的基因修改。
非同源末端连接(NHEJ)
断裂的 DNA 直接连接起来,但这一过程经常伴随着碱基的随机插入或缺失(indels)。如果这些 indels 不是 3 的倍数,可能导致移码突变,进而破坏基因功能,这种方式适合于敲除基因。
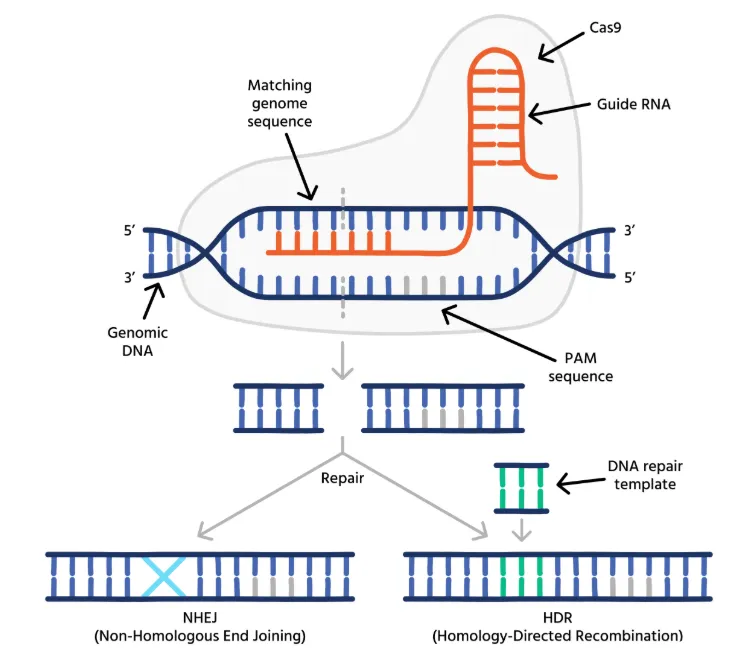
通过以上两个修复途径,CRISPR-Cas 系统不仅能破坏目标基因,还能实现精准的基因编辑,因此在生物医学中得到了广泛应用。



 扫码安装网站APP(Android版)
扫码安装网站APP(Android版)


近期评论