来源公众号:Bio逸趣 作者:Frdbio
上篇推文什么是甲基化?为啥要甲基化?有热心读者留言说RNA甲基化的m6A目前是热点,建议加上。非常感谢这位网友,于是特此开篇讲述这个问题。
在传统观念中,表观遗传学常被理解为围绕DNA和组蛋白展开的修饰机制,例如DNA甲基化、组蛋白乙酰化等。然而,近年来一个崭新的研究领域正在迅速兴起,那就是RNA层面的修饰调控——被称为“表观遗传2.0”。这一领域的核心,正是RNA甲基化。
目前已知的RNA化学修饰超过170种,其中具有代表性的包括:N6-甲基腺嘌呤(m6A)、5-甲基胞嘧啶(m5C)、1-甲基腺嘌呤(m1A)、伪尿苷(Ψ)以及2′-O-甲基化(Nm)等。这些修饰广泛存在于mRNA、tRNA、rRNA和非编码RNA中,调控着RNA的稳定性、剪接、核输出、翻译效率甚至降解速度。
其中,最为研究深入、调控功能最全面的修饰当属m6A。作为哺乳动物mRNA中最丰富的内部修饰形式,m6A主要由“写入酶”(METTL3/METTL14复合物)在特定位点添加而来,可被“擦除酶”(如FTO、ALKBH5)移除,并被“读取蛋白”(如YTHDF1/2/3、IGF2BP等)识别。这一“写-擦-读”动态体系赋予了RNA与DNA相似的调控能力,使其成为细胞命运决策的重要枢纽。
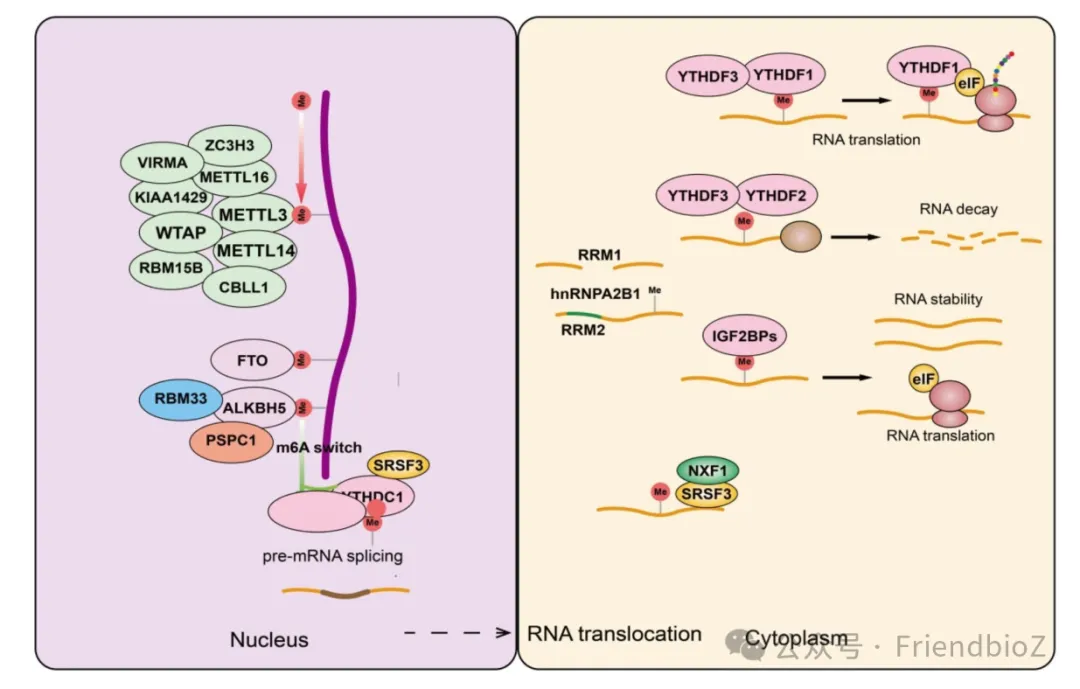
图片来源于参考文献1:m6A修饰的生物过程。m6A修饰过程包括三个步骤:“写入”、“擦除”和“读取”。首先,甲基转移酶复合物(包括催化亚基METTL3、辅助催化亚基METTL14和调节蛋白,如WTAP)催化腺苷N6位添加甲基,这一步骤称为“写入”。接下来,脱甲基酶(如FTO和ALKBH5)可以从RNA中去除m6A修饰,这一过程称为“擦除”,允许对修饰进行动态调节。此外,m6A修饰被“阅读器”蛋白(如YTH/IGF2BP家族)识别,这些蛋白调节mRNA的命运,包括其翻译效率、稳定性、定位和剪接。
m6A修饰在多个层面调控RNA行为:它可调节mRNA的选择性剪接、增强翻译效率、促进或阻止降解,并在胚胎发育、干细胞自我更新、自噬及神经系统成熟等过程中发挥不可替代的作用。研究发现,m6A修饰甚至能够通过诱导RNA的结构变化,暴露或隐藏特定结合位点,进而控制RNA与蛋白质的互作模式。
近年来,m6A修饰在免疫系统中的研究尤为引人注目。在先天免疫中,m6A通过调节干扰素通路相关mRNA的稳定性来影响抗病毒反应;在适应性免疫中,T细胞的激活、极化与耗竭过程均受到m6A调控通路的深度参与。此外,肿瘤细胞可通过m6A调节免疫检查点(如PD-L1)的表达,逃避免疫系统识别。这一现象提示m6A不仅是癌症发生发展的关键因子,也可能成为肿瘤免疫治疗的重要靶点。例如,ALKBH5去甲基化酶的抑制已被证实可增强PD-1免疫治疗的疗效。
为了深入理解m6A的功能机制,检测技术也经历了快速演进。最初的MeRIP-seq和m6A-seq技术虽能识别修饰区域,但缺乏单碱基分辨率。随后miCLIP、DART-seq等技术提升了定位精度和样本适应性。近年来,GLORI技术的出现为转录组范围内的m6A修饰检测带来了革命性突破。该技术结合了化学氧化和高通量测序,能够在低样本输入下实现单碱基分辨的定量检测,尤其适合临床转化研究。
同时,人工智能也开始融入RNA修饰研究。例如2024年提出的BERT-Deg深度学习模型,利用大数据训练预测YTHDF2介导的mRNA降解靶标,并可辅助筛选潜在药物作用位点。这类工具的加入不仅拓展了m6A研究的广度,也提升了RNA药物开发的效率与精度。
综上所述,m6A修饰正逐渐成为RNA世界中最核心的调控机制之一。它以“分子开关”的身份,精准调节RNA命运,在细胞生长、分化、应激应答及免疫调节等多个维度发挥作用。随着检测技术的飞跃和AI的加持,RNA甲基化研究正迈向个性化诊疗和精准医疗的新时代。
来源网址:补充一下RNA甲基化,聊聊热点明星m6A



 扫码安装网站APP(Android版)
扫码安装网站APP(Android版)


近期评论