来源公众号:生物奇迹biomiracle
在单克隆抗体制备领域,细胞融合是获得杂交瘤细胞的关键环节。为何要将 B 淋巴细胞与骨髓瘤细胞融合?如何通过技术手段实现二者的有效结合?PEG 法作为常用技术,其具体操作步骤和核心要点是什么?
细胞融合原理
单克隆抗体制备需要结合两种细胞的优势特性。免疫动物脾脏中的 B 淋巴细胞,经抗原刺激后能够分泌特异性抗体,但在体外培养时存活时间不长,一般只能存活 1 – 2 周,无法持续增殖。而骨髓瘤细胞源自小鼠骨髓瘤,具备无限增殖的能力,不过它天然状态下不会分泌抗体,并且通常缺少次黄嘌呤 – 鸟嘌呤磷酸核糖转移酶(HGPRT⁻)或胸腺嘧啶激酶(TK⁻),其合成 DNA 依赖从头合成途径。
细胞融合的目的,就是将 B 淋巴细胞和骨髓瘤细胞融合在一起,让两种细胞的遗传物质相互重组。这样得到的杂交瘤细胞,既能保持 B 细胞分泌抗体的功能,又能获得骨髓瘤细胞无限增殖的特性。同时,由于杂交瘤细胞保留了 B 细胞的 HGPRT,在后续的 HAT 筛选培养基中能够存活下来,而未融合的骨髓瘤细胞会因为缺乏 HGPRT 或 TK 而死亡。
从细胞膜的层面来看,细胞膜由磷脂双分子层构成,本身具有流动性。在物理、化学或生物因素的作用下,细胞膜的脂双层结构会暂时被破坏。比如使用化学试剂 PEG(聚乙二醇)时,它作为脱水剂,能减少细胞间的水分,使细胞膜脂分子排列变得紊乱,降低膜表面电荷的排斥力,让相邻细胞的细胞膜紧密接触,最终形成融合孔,实现细胞融合。
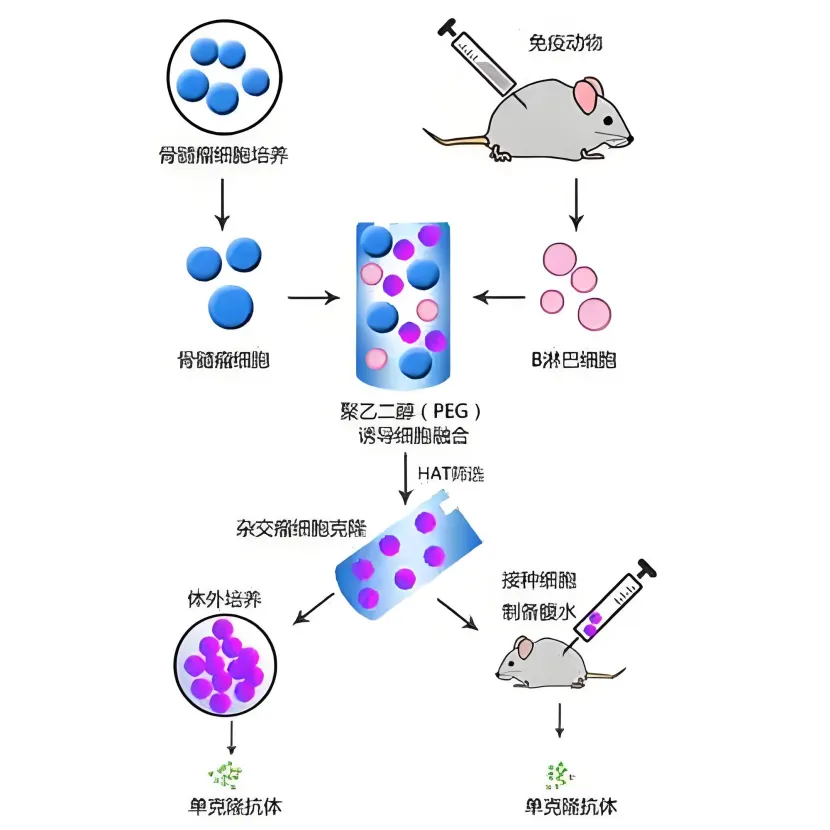
细胞融合方法(以 PEG 法为例)
01 细胞准备
骨髓瘤细胞培养:在单克隆抗体制备中,常用小鼠来源的 SP2/0、NS0 或 P3 – X63 – Ag8.653 等骨髓瘤细胞株,这些细胞都属于 HGPRT⁻或 TK⁻类型,以便后续在 HAT 筛选培养基中筛选。培养时,使用含 10% 胎牛血清(FBS)的 RPMI 1640 培养基,在 37℃、5% CO₂的培养箱环境中进行。要选取处于对数生长期的细胞,此时细胞活力强,活力需达到 95% 以上,并且细胞形态呈现圆润、分散良好的状态。在融合前 1 – 2 天要对细胞进行传代,防止细胞老化,融合前还要用无血清培养基洗涤细胞 2 次,去除血清中可能影响融合的成分。
脾细胞制备:在末次免疫后的 3 – 4 天,是脾脏中抗原特异性 B 细胞数量最多的时候,此时进行取材。具体操作是在无菌条件下取出免疫小鼠的脾脏,用剪刀剪碎后,通过 200 目细胞筛研磨,得到单细胞悬液。接着将细胞悬液离心,转速 1500 rpm,时间 5 分钟,倒掉上清液,再用 PBS 或无血清培养基重新悬浮细胞,并进行细胞计数,一般一只 Balb/c 小鼠能获取 5×10⁷ – 108个脾细胞。最后通过台盼蓝染色检测细胞活力,活细胞比例需达到 90% 以上才能用于融合。
02 细胞融合操作流程
细胞混合与离心:按照脾细胞和骨髓瘤细胞 5:1 – 10:1 的比例进行混合,一般取 5×10⁷个脾细胞搭配 1×10⁷个骨髓瘤细胞。将混合后的细胞悬液进行离心,转速 1500 rpm,时间 5 分钟,离心后倒掉上清液,然后用吸管轻轻弹动管底,让细胞沉淀松散开,防止细胞结块影响后续融合效果。
PEG 诱导融合:先将 50% PEG 4000(分子量 4000,溶解在无血清培养基中,调节 pH 至 7.2 – 7.4)和无血清培养基预热到 37℃。在 37℃的环境下,用 1 mL 吸管在 1 分钟内缓慢滴加 1 mL 50% PEG 到细胞沉淀中,滴加过程中要轻轻旋转试管,让 PEG 均匀接触细胞,滴加完成后,在 37℃下静置 1 – 2 分钟,时间过长会增加细胞死亡率。
终止融合反应:在 1 – 2 分钟内,缓慢加入 5 mL 预热到 37℃的无血清培养基,边加边轻轻摇晃试管,逐步稀释 PEG,减轻它对细胞的毒性。随后以 1000 rpm 的转速离心 5 分钟,倒掉上清液,用 HAT 培养基重新悬浮细胞,得到的融合细胞就是杂交瘤细胞,需要马上进行筛选。
03 融合后处理—— 铺板与筛选
将融合后的细胞悬液接种到 96 孔细胞培养板中,每孔加入 2 – 5×10⁴个细胞,保证后续 HAT 筛选时细胞有合适的密度。把培养板放入培养箱,使用 HAT 培养基培养细胞。在 HAT 培养基的筛选作用下,未融合的骨髓瘤细胞因为 HGPRT⁻/TK⁻无法利用补救途径合成 DNA 而死亡,未融合的脾细胞也会自然凋亡,只有杂交瘤细胞能够存活并增殖。培养过程中,每 2 – 3 天更换一次培养基,7 – 10 天左右就能看到杂交瘤细胞克隆形成。
细胞融合关键要点
细胞状态把控:骨髓瘤细胞必须处于对数生长期,活力达到 95% 以上,老化的细胞会降低融合成功率。制备脾细胞时,操作要轻柔,避免过度研磨造成细胞损伤,台盼蓝染色检测的死细胞率应低于 10%。
PEG 使用规范:PEG 的分子量选择 4000 较为合适,分子量过大细胞毒性高,过小融合效率低;浓度确定为 50%,需要现配并将 pH 值调节到中性;使用时要严格保持 37℃的温度,温度过低膜流动性差,过高则会损伤细胞。
操作细节注意:离心后要确保上清液完全倒掉,残留的培养基血清会影响 PEG 的作用。滴加 PEG 和终止液时,速度要缓慢、均匀,防止局部浓度过高导致大量细胞死亡。一般来说,细胞融合的效率在 1% – 10% 左右,也就是每 10⁶个骨髓瘤细胞能形成 10⁴ – 10⁵个杂交瘤细胞,实际经过 HAT 筛选后,阳性克隆的比例会更低,还需要后续的抗体检测来进一步验证。
除了 PEG 法,细胞融合还有电融合法和病毒融合法。电融合法是利用电脉冲使细胞膜穿孔后实现融合,它的优点是效率高、细胞毒性低,但需要专用设备,参数优化也比较复杂,适合大规模细胞融合研究;病毒融合法是借助仙台病毒包膜蛋白来介导膜融合,虽然效率高、特异性强,但病毒制备过程复杂,安全性较低,在早期研究中使用较多,现在已较少采用。



 扫码安装网站APP(Android版)
扫码安装网站APP(Android版)


近期评论