来源公众号:Glyco-Immunology 作者:Bicycle
树突状细胞(Dendritic Cells, DCs)
树突状细胞(DCs)是功能强大的抗原呈递细胞(Antigen-Presenting Cells, APCs),在启动和调控先天性免疫和适应性免疫中发挥核心作用。DCs因其外形上多突起的分支状结构而得名。
1. DCs的发现与分类
发现历史:
DCs最早由Ralph Steinman和Zanvil Cohn于1973年在小鼠脾脏中发现,因其独特的形态和功能被命名为“树突状细胞”。Ralph Steinman因其在DC领域的研究于2011年获得诺贝尔生理学或医学奖。
分类:
根据发育来源和功能,DCs分为以下几类:
cDC1:特化于交叉呈递(Cross-Presentation)抗原给CD8⁺ T细胞。
cDC2:特化于呈递抗原给CD4⁺ T细胞。
经典DCs(Conventional DCs, cDCs):主要负责抗原的摄取、加工和呈递,分为:
浆细胞样DCs(Plasmacytoid DCs, pDCs):主要负责分泌I型干扰素(如IFN-α),在抗病毒免疫中关键。
单核细胞来源的DCs(Monocyte-Derived DCs, moDCs):在炎症环境下由单核细胞分化而来。
朗格汉斯细胞(Langerhans Cells, LCs):分布在皮肤表皮,具有DC功能,但属于独特的组织驻留细胞。
2. 分布与形态
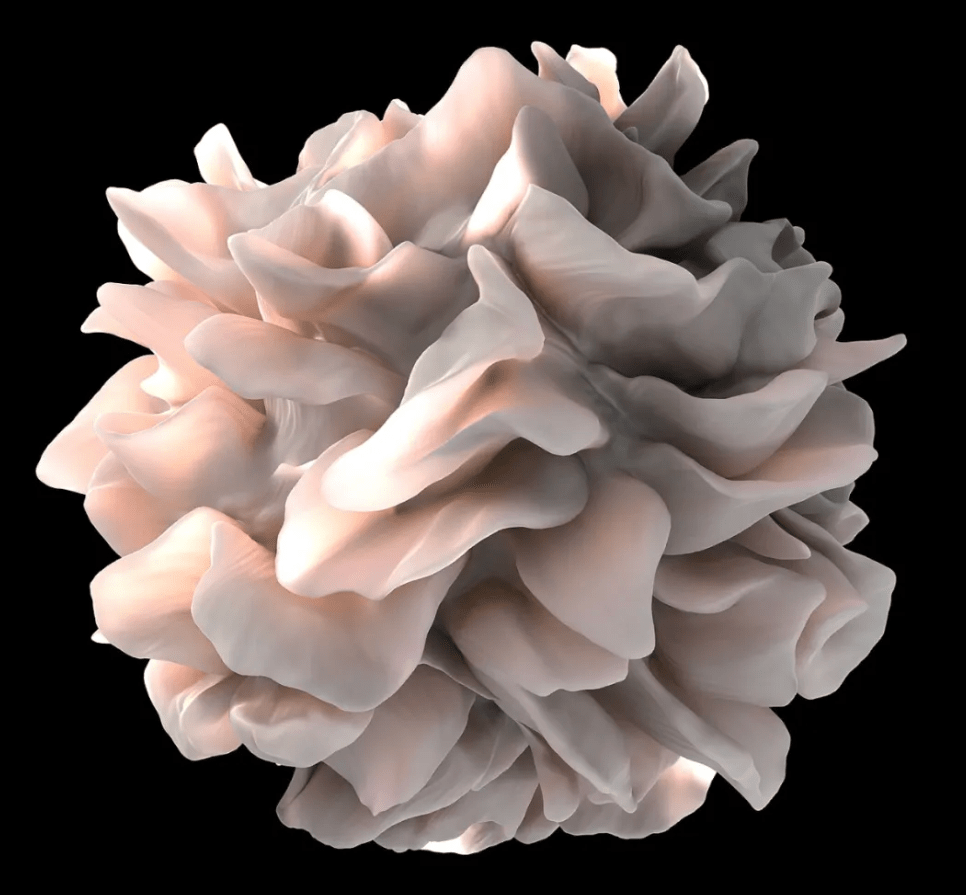
分布:
DCs广泛存在于皮肤(如朗格汉斯细胞)、黏膜组织(如肺、肠道)、淋巴结、脾脏及其他组织。
在组织中,DCs主要以不成熟形式存在,负责监视微环境并捕获抗原。
在淋巴结等二级淋巴器官中,DCs通常以成熟形式呈现抗原。
形态:
DCs具有典型的分支样伪足结构,这种形态使其具有较大的表面积用于捕获和处理抗原。
3. 功能
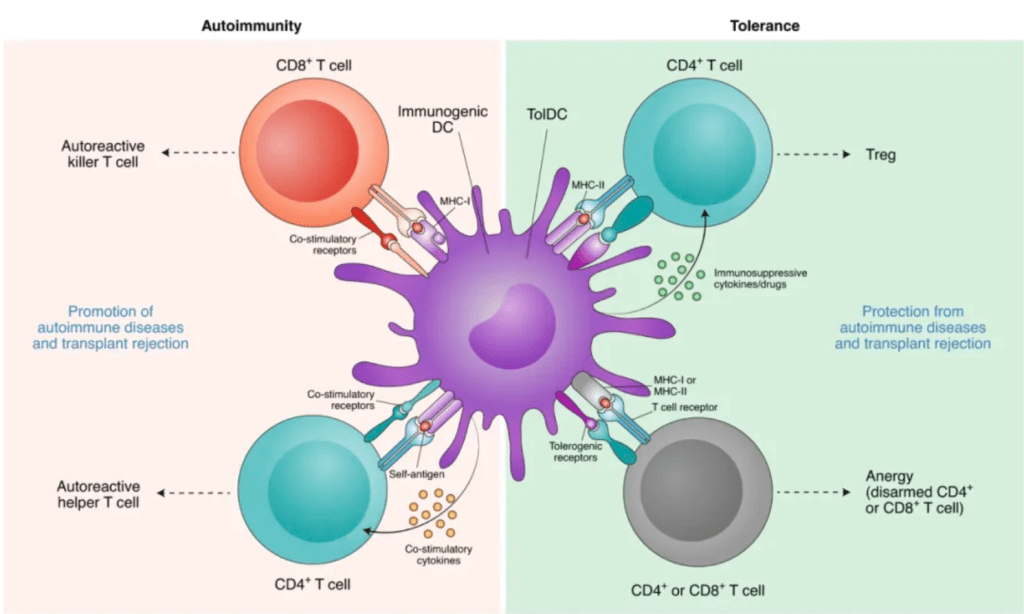
抗原捕获与加工:
DCs通过模式识别受体(Pattern Recognition Receptors, PRRs)如Toll样受体(TLRs)、C型凝集素样受体(CLRs)识别并摄取抗原。
捕获方式包括吞噬(Phagocytosis)、胞饮(Macropinocytosis)和受体介导的内吞。
摄取的抗原被加工并装载到主要组织相容性复合体(MHC)分子上。
抗原呈递:
MHC I类分子:交叉呈递抗原给CD8⁺ T细胞(如杀伤性T细胞)。
MHC II类分子:呈递抗原给CD4⁺ T细胞(如辅助性T细胞)。
DCs将抗原片段呈递给T细胞,激活适应性免疫反应:
刺激免疫反应:
通过表达共刺激分子(如CD80/CD86)和分泌细胞因子(如IL-12、IL-10)调控T细胞的活化和分化。
耐受性诱导:
在稳态条件下,DCs可诱导T细胞免疫耐受,防止自身免疫反应。
与B细胞的互作:
提供抗原给B细胞并促进其活化。
4. DCs的发育与分化
起源: DCs由骨髓中的造血干细胞分化而来,通过不同发育路径生成特定亚群:
髓系DCs(Myeloid DCs):由骨髓髓系祖细胞分化。
浆细胞样DCs(pDCs):起源于髓系或淋巴系前体细胞。
发育关键因子:
转录因子:如BATF3(cDC1分化所需)、IRF8、IRF4等。
细胞因子:如GM-CSF(粒细胞-巨噬细胞集落刺激因子)和Flt3L(Fms样酪氨酸激酶配体)。
5. 成熟与活化

不成熟DCs:
表达高水平的抗原捕获相关受体,但低水平的MHC分子和共刺激分子。
主要功能是抗原捕获。
成熟DCs:
在接触病原体或炎症信号后,DCs被激活并迁移到淋巴器官。
表达高水平的MHC分子、共刺激分子(如CD80、CD86)和趋化因子受体(如CCR7),促进与T细胞的相互作用。
6. DCs在疾病中的作用
感染性疾病:
DCs通过识别病原体相关分子模式(PAMPs)激活先天免疫。
分泌细胞因子(如IFN-α、IL-12)参与抗病毒和抗细菌免疫。
肿瘤免疫:
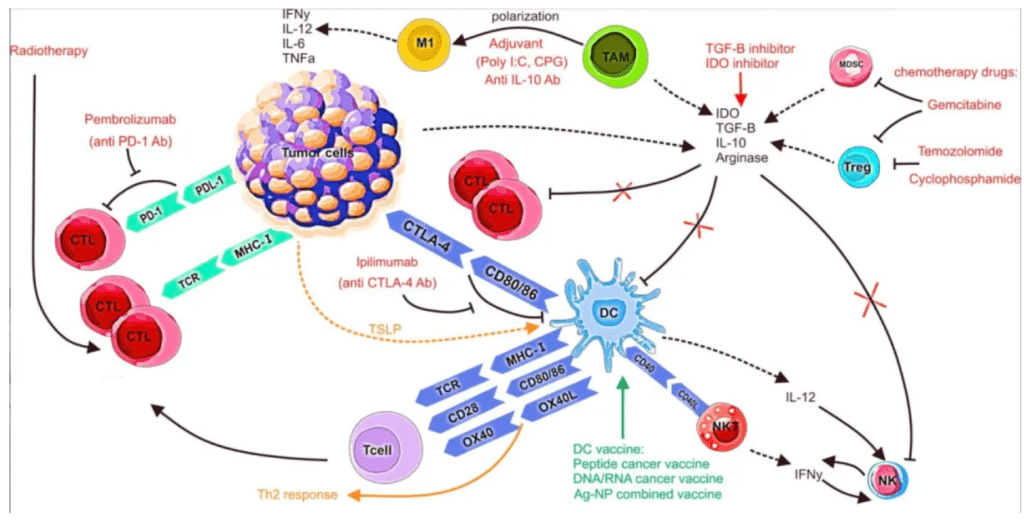
DCs可摄取肿瘤抗原并通过交叉呈递激活抗肿瘤CD8⁺ T细胞。
肿瘤微环境中的抑制信号可能导致DCs功能低下。
自身免疫:
异常激活的DCs可能在某些自身免疫疾病(如系统性红斑狼疮、类风湿性关节炎)中诱导免疫病理反应。
疫苗开发:
DCs因其优越的抗原呈递能力,广泛应用于癌症疫苗、传染病疫苗的研发。
7. 研究与应用前景
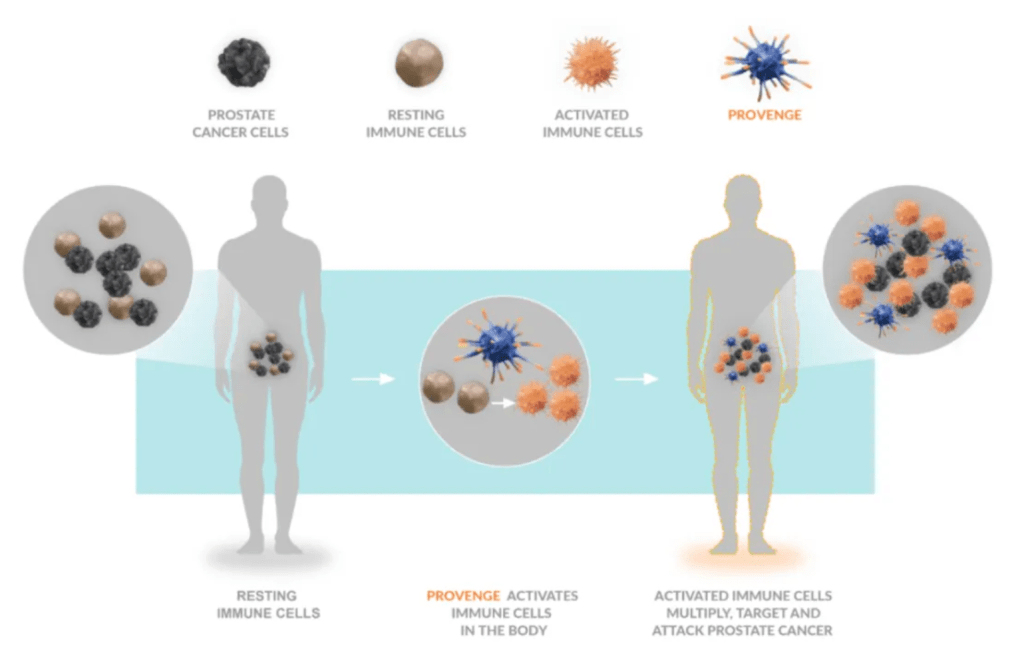
DC疫苗:
将DCs体外负载特定抗原后回输到患者体内,可用于癌症和传染病治疗。
已获批准的DC疫苗:Provenge(用于前列腺癌治疗)。
调控DC功能:
开发靶向DCs的免疫调节剂,用于治疗炎症性疾病和自身免疫病。
基因工程改造:
利用基因编辑技术增强DCs的抗原呈递能力或调节其细胞因子分泌。
参考文献:
Cell Immunol. 2012, 273 (2), 95.
Nature Nanotechnology, 2021, 16, 37–46
推荐阅读:
来源网址:看透一个免疫细胞:DC



 扫码安装网站APP(Android版)
扫码安装网站APP(Android版)



近期评论