来源公众号:生物学通报 作者:罗淋淋
文章来源:罗淋淋.高中生物学 PCR 实验教学方法的优化与改进[J]. 生物学通报, 2025, 60(3): 55-57.
编者按
为了更好地满足读者对优秀期刊文章的需求,本刊微信公众号择优推送当期文章,持续推送,敬请关注!
本刊2025年第3期刊发的《高中生物学 PCR 实验教学方法的优化与改进》一文,通过快速 DNA 提取技术、优化 PCR 反应体系、缩短 PCR 反应时间及电泳时间,实现在单个学时内顺利完成从 DNA 提取到 PCR 反应及其产物的电泳检测实验,本期荐读。
高中生物学 PCR 实验教学方法的优化与改进
罗淋淋(广东省深圳市红山中学)
摘 要 结合教学实践对原实验方案进行优化改进,通过快速 DNA 提取技术、优化 PCR 反应体系、缩短 PCR 反应时间及电泳时间,实现在单个学时内顺利完成从 DNA 提取到 PCR 反应及其产物的电泳检测实验。该实验方法能够大幅度缩短本课程所需要的时间,提高实践教学效果,适宜在教学过程中推广。
关键词 PCR DNA 电泳 高中生物学
DNA 提取、聚合酶链式反应(PCR)与琼脂糖凝胶电泳属于基因工程中获取目的基因的操作步骤。通常情况下,常规基因组 DNA 的提取所需时间为 3 h,PCR 反应所需时间为 1.5~2.0 h,琼脂糖凝胶电泳检测实验所需时间约 1 h。因此,完成从 DNA 提取到 PCR 反应及其产物的检测实验所需时间至少为 5.5 h,这对高中生物学课堂来说难以实现。因此,探究更加快捷高效的 PCR 实验教学方法是非常有必要的。
1 实验方法优化方案探究
1.1优化 DNA 提取方法,实现 DNA 的快速提取
目前,实验室常用的 DNA 提取方法包括十二烷基硫酸钠(SDS)法、十六烷基三甲基溴化铵(CTAB)法和使用 DNA 提取试剂盒等,这些方法较为繁琐、操作难度大、耗时过长,且部分试剂对人体有毒有害。此外,在提取过程 中产生大量废液造成环境的污染。因此,上述实验方法不适合在高中生物学的课堂开展。根据文献分析可知,现已报道多种优化的快速基因组提取方法,其中李琳等提出的“一种植物基因组 DNA 快速提取方法”能够高效、准确、适用性广地提取 DNA,该项技术可以引入高中生物学课程。
提取步骤 :取面积为 3~5mm2的水稻叶片 ,置于 1.5 mL 的 EP离心管中,加入 2 粒钢珠,将EP 管置于组织破碎仪中打碎样品(60 Hz,30 s);或者可用研磨棒磨碎样品,至有绿色的组织液流出即可。向每个 EP 管中加入 200 μL DNA 提取液,本实验所使用 DNA 10× 提取缓冲液母液配制方法:100 mmol/L Tris(pH=9.5)、5 mmol/L 乙二胺四乙酸(EDTA)、5 mmol/L NaCl 和 1 mmol/ L KCl,用去离子水稀释至 1×即可使用。盖上 EP 管的盖子,上下颠倒几次,混匀。最后将 EP管置于离心机中 10 000 r/min 离 心 30 s,即完成了 DNA 的粗提过程,此过程耗时 2~3 min。本实验设置 3 个样本,1 号样本采用 CTAB 法提取 DNA 同时使用 3 个 DNA 样本进行下一步的 PCR 实验。
1.2优化 PCR 反应体系,高效完成 PCR 实验
PCR 技术广泛应用于临床医学和科研实验室,其基本原理为在体外模拟细胞内 DNA 复制的相关条件,并最终完成特定 DNA 片段的体外复制和扩增过程。该项技术主要分为变性、退火、延伸 3 个步骤:变性是使模板 DNA 双链解旋成为单链,以便与引物序列相结合;退火是在模 板变性成单链后,快速降温至退火温度,促进引物按照碱基互补配对的原则与单链模板 DNA 的互补序列相结合;延伸是在 Taq 酶的作用下,促进模板-引物沿着 5′→3′的方向合成一条与模板 DNA 链互补的链。
本实验采用的 Taq 酶为 Vazyme 高纯度耐热 DNA聚合酶(2×Taq master mix,Dye Plus,P112-01), 该混合体系包含 PCR 反应所需要的 DNA 聚合酶和缓冲液,反应时只需要加入引物和 DNA 即可。通过 NCBI 数据库检索获得水稻(Oryza sativa L.)primiR159 基因序列,并通过 Primer-BLAST 在线系统 检索获得引物序列pri-miR159-F 为 TCGGTCCAAAAAGGGGTGTT,pri-miR159-R 为 AGCATGGCGATAGAAGCAAC,选择目标基因的长度为 300 bp。为缩短实验时间并探究不同循环数对 PCR 反应扩增效率的影响,本实验对 1、2 和 3 号样本设置循环数分别为 25、30 和 35 个,总反应时间分别为 35、40 和 46 min。
反应体系组成:2×Taq Master Mix(Dye Plus) 10.0 μL;引 物 pri-miR159-F(10 nmol /L)0.5 μL,引物 pri-miR159-R(10 nmol /L)0.5 μL;DNA 提取液 0.5~1.0 μL;双蒸水补足总体积 20.0 μL。
PCR 反应条件为 95℃ 3 min;95℃ 30 s、56℃ 30 s、72℃ 10 s;完成循环后最终 72℃ 3 min。在实验操作过程中,PCR 反应体系可根据样本来源和实验用途稍作调整。
1.3琼脂糖凝胶电泳检测方法
1.3.1 配制凝胶
配制 1% 的琼脂糖凝胶,加入核酸染料[Vazyme,Ultra GelRed(10 000×),GR501- 01],将胶液倒入电泳模具中静置约 20 min,将凝胶放入电泳槽时要注意电极极性。
1.3.2 电泳及检测
扩增后的 PCR 产物注入胶孔中 ,Maker 为 Vazyme DL2000 Plus DNA Marker (MD101-01)。为加快电泳检测的时间,实验设计 5、10 和 15 min,不同的电泳时间电压均为 160 V。电泳结束后使用荧光凝胶成像仪在电脑上观察电泳结果,并将结果存档。
2 结果与分析
2.1不同 PCR 循环数目的电泳检测结果及分析
检测了不同 PCR 的循环数目对实验结果的影响,结果如图 1 所示。在不同的 PCR 循环数下,3 组 PCR 产物的条带整齐单一,说明采用本实验方法 3 种 DNA 都能够扩增出目的基因片段。其中,与 1 号样本相比,样本 2 号和 3 号的条带较浅,说明:相比 CTAB 法提取的 DNA,快速提取法提取的 DNA 的 PCR 扩增效率较低。这种差异在 30 和 35 个循环时也存在,可能是快速 DNA 提取法的 DNA 模板浓度较低,后续 PCR 实验时可以适当增加快速 DNA 提取法中模板的量。通过该实验结果,得出结论:PCR 反应的循环数目为 30 个即可满足实验的需求,又能缩短反应所需要的时间。
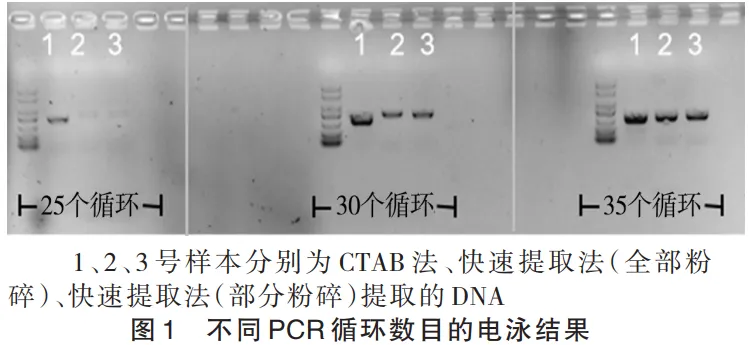
2.2不同电泳时间检测结果及分析
分析图 1 可知,快速 DNA 提取法获得的 DNA 浓度较低。因此,在新一轮的 PCR 反应体系中,模板 DNA 的量增加为 2 μL(双蒸水的量减少 1 μL),而 CTAB 法提取的 DNA 的模板量仍为 1 μL。PCR 的循环数目为 30 个循环数,其余的反应体系和反应条件不变。为有效缩短凝胶电泳所需要的时间,提高实验效率,本实验探究了不同凝胶电泳时间下 PCR 产物的电泳结果,如图 2 所示。根据结果分析可得:在凝胶电泳时间为 5、10 和 15 min 时都能清晰地看到目的基因片段,随着电泳时间的增加,目的基因移动的距离越远。
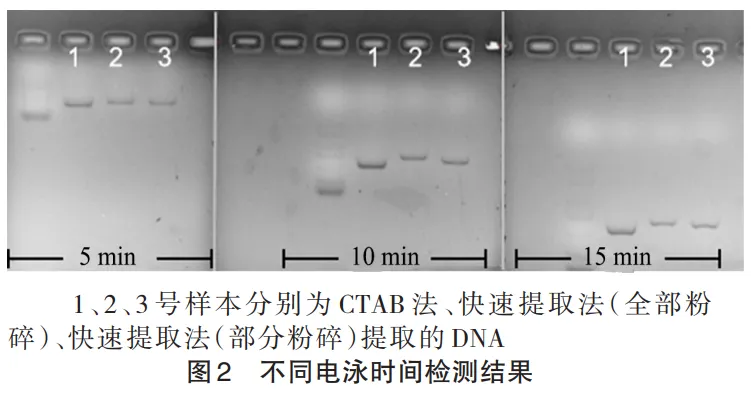
文献报道不同的 DNA 提取方法对 DNA 的提取效果有影响,会影响浓度、纯度和 DNA 片段的 完整性。如图 2 所示,与 CTAB 法相比,快速 DNA 提取法的条带亮度较浅且随着凝胶电泳时间的推移,PCR 结果显示 3 组片段大小稍微有差异,说明快速提取 DNA 法提取的 DNA 浓度较低,且 DNA 完整性有一定的损失。高中生物学教学重点指导学生初步认识 DNA 提取和 PCR 技术,重在知识的理解和应用,不过度重于科学研究,所以本实验方法能够满足课程需要。根据实验结果得到结论:凝胶电泳时间为 5 min 即可满足实验需要。
3 结语
本实验通过快速 DNA 提取技术和优化的 PCR 反应体系,在 160 V 的电压下,电泳时间设 置为 5 min,最终可在 45 min 内完成 DNA 提取及 PCR 反应和电泳检测实验,且实验结果可满足高中学生实验需要。本实验方法能够使学生更好地理解和实践基因工程技术,有助于教师分配时间用于解释实验原理、总结实验结果,帮助学生提高分析、解决问题的能力,同时能够满足 PCR 与电泳实验的教学需求,达到提高实验教学的效果。
本实验方法其他的优点:1)实验步骤简单易学,有助于零基础的高中生动手实践。2)减少实验过程中使用的试剂种类,特别是有毒试剂的使用,有效提高实验的安全性和可操作性。3)可应用的样本种类广泛,可操作性强。本实验方法可应用于探究性实验,鼓励学生主动探索科学。课后学生可将此套实验方法应用于检测不同物种的基因,或者检测基因在同一个物种的不同组织中的表达情况。在课上,学生认识并熟练掌握 DNA 提取、PCR 扩增和电泳检测等相关技术,能够有效掌握科学探究的一般流程,提高学生的综合实验技能、探究能力和创新精神。



 扫码安装网站APP(Android版)
扫码安装网站APP(Android版)



近期评论